Understand their needs Translate and expand scope of coverage
 의료기기 컨설팅 > 국내컨설팅
의료기기 컨설팅 > 국내컨설팅
 |
의료기기 GMP 제도는 의료기기의 설계 및 개발, 제조, 시판 후 관리 등 전 과정에 대한 품질시스템의 확보를 통해 안전(safe)하고, 유효(effective)하며, 의도된 용도(intended use)에 적합한 품질의 제품을 일관성 있게(consistently) 생산하는 것을 보장하기 위한 품질보증 시스템입니다. 의료기기를 제조 또는 수입하는 업체는 의료기기법에 따라 반드시 품질관리 적합인정(GMP)을 받아야 제조 및 판매 활동을 할 수 있습니다. |
|---|
·의료기기법, 의료기기법 시행령, 의료기기법 시행규칙
·의료기기 제조 및 품질관리기준(식품의약품안전처고시)
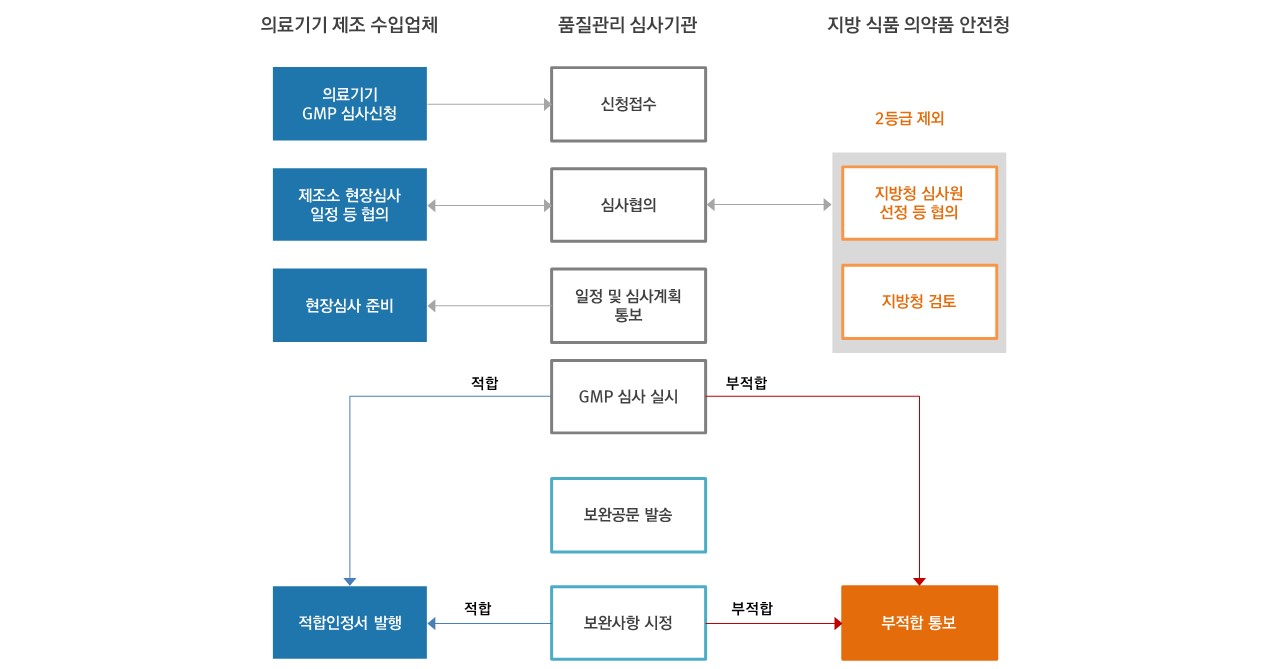
- 최초심사 : 제조 또는 수입 의료기기가 이 기준에 적합함을 인정받기 위해 최초로 받아야 하는 심사
- 정기심사 : 최초심사 후 3년 주기로 실시하는 사후 관리 심사 (유효기간 만료일 90일 이전에 신청하여야 함)
- 추가심사 : 품목군을 새로이 추가하는 심사
- 변경심사 : 제조소의 소재지 변경에 따라 적합성평가를 새로이 받아야 하는 심사 (다만, 제품의 품질과 관계가 적은 보관소 및 시험실의 변경은 제외)

의료기기법 제 2조에 따른 의료기기 및 의료용품의 정의에 부합하는 제품에 대해서는 제조 또는수입 품목 허가를 받아야 판매 활동이 가능합니다.
의료기기법 제 2조(정의)
사람이나 동물에게 단독 또는 조합하여 사용되는 기구·기계·장치·재료 또는 이와 유사한 제품으로서 다음 각 호의 어느 하나에 해당하는 제품을 말한다. (다만, 「약사법」에 따른 의약품과 의약외품 및 「장애인복지법」 제65조에 따른 장애인보조기구 중 의지·보조기는 제외)
- 질병을 진단·치료·경감·처치 또는 예방할 목적으로 사용되는 제품
- 상해 또는 장애를 진단·치료·경감 또는 보정할 목적으로 사용되는 제품
- 구조 또는 기능을 검사·대체 또는 변형할 목적으로 사용되는 제품
- 임신을 조절할 목적으로 사용되는 제품
식품의약품안전처장은 의료기기의 사용목적과 사용 시 인체에 미치는 잠재적 위해성 등의 차이에 따라 체계적ㆍ합리적으로 안전관리를 할 수 있도록 의료기기의 등급을 분류합니다. 분류기준은 다음과 같습니다.
| 1등급 : 잠재적 위해성이 거의 없는 의료기기 |
※ 의료기기 등급분류의 잠재적 위해성에 대한 판단기준
|
| 2등급 : 잠재적 위해성이 낮은 의료기기 | |
| 3등급 : 중증도의 잠재적 위해성을 가진 의료기기 | |
| 4등급 : 고도의 위해성을 가진 의료기기 |
| 1등급 | 2, 3, 4 등급 (임상X) | 2, 3, 4 등급 (임상O) | |
|---|---|---|---|
| 제조 | 제조품목신고(1등급) | 제조품목허가(2,3,4 등급) | 제조품목허가(임상)(2,3,4 등급) |
| 수입 | 수입품목신고(1등급) | 수입품목허가(2,3,4등급) | 수입품목허가(임상)(2,3,4등급) |
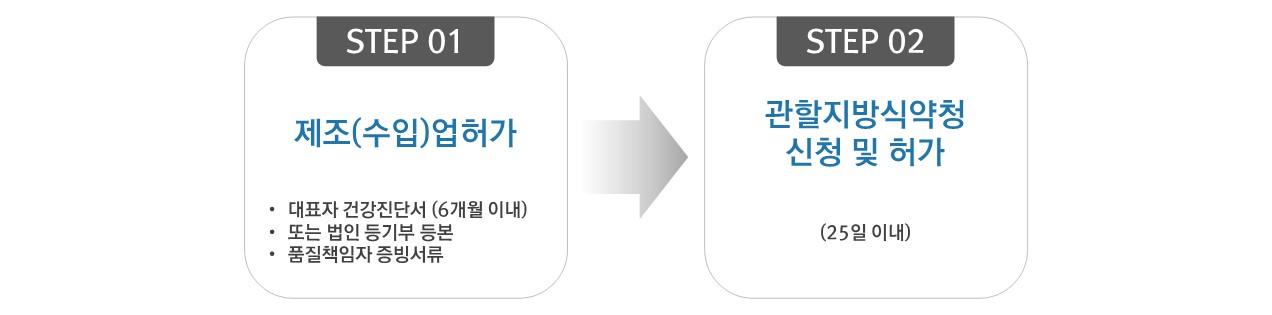
1. 업허가
제조/수입
▷ 허가대상 : 의료기기 제조/수입을 업으로 하고자 하는 자
▷ 처리절차
- 처리기관 : 관할 지방식품의약품안전청
- 처리기간 : 25일
▷ 허가 시 유의사항 : 업허가 신청시 1개 이상의 제조/수입품목허가(신고)를 동시에 접수하여야 함
▷ 허가 처리 절차
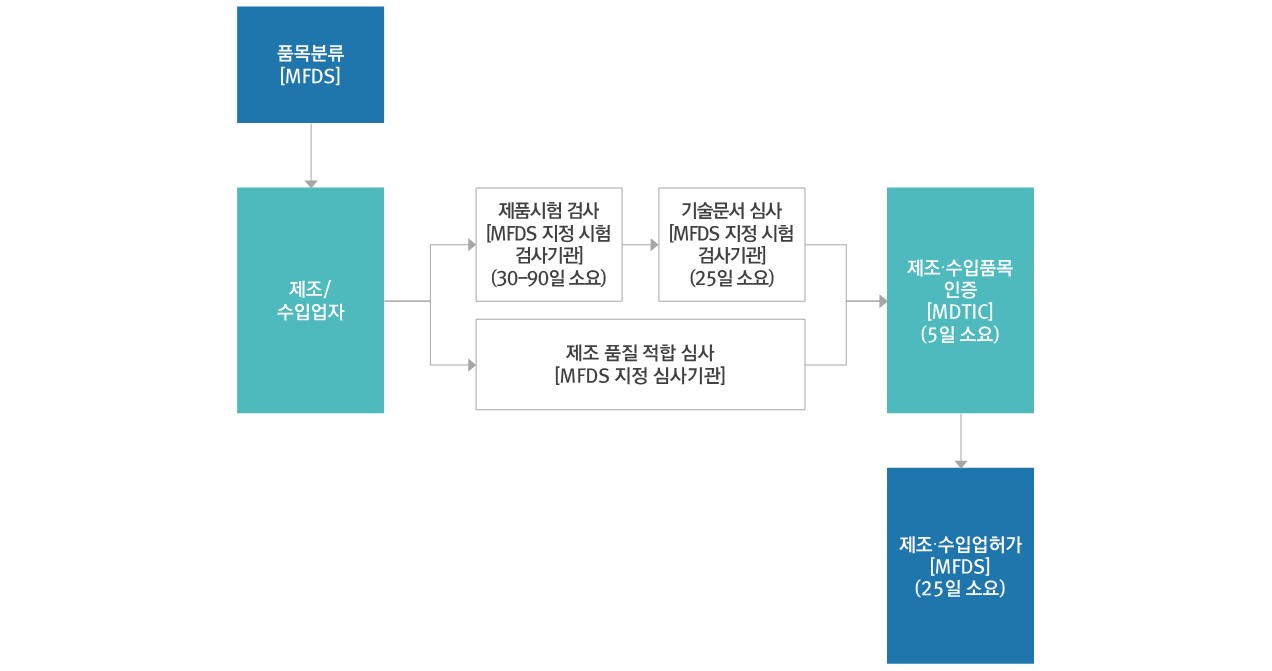
2. 품목허가
제조/수입
▷ 허가대상 : 제조/수입 품목허가를 받고자 하는 자
▷ 처리절차 :
- 접수방법 : 식약처 의료기기 민원사이트 접수 가능
▷ 처리기간 : 25일
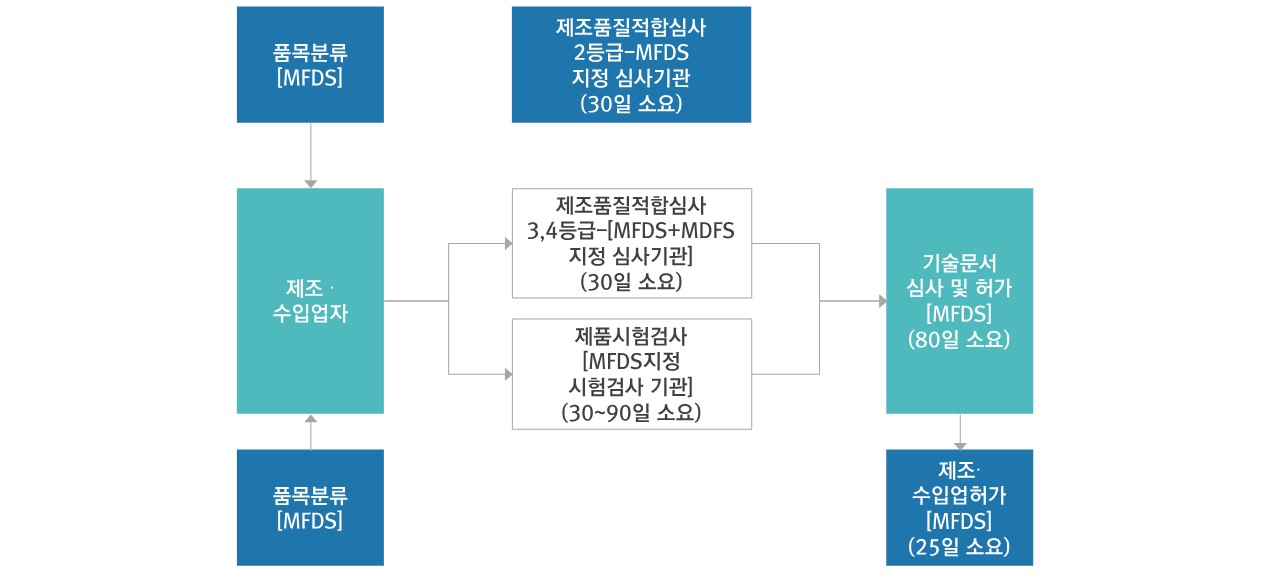
- 안전성·유효성 심사필요 : 80일
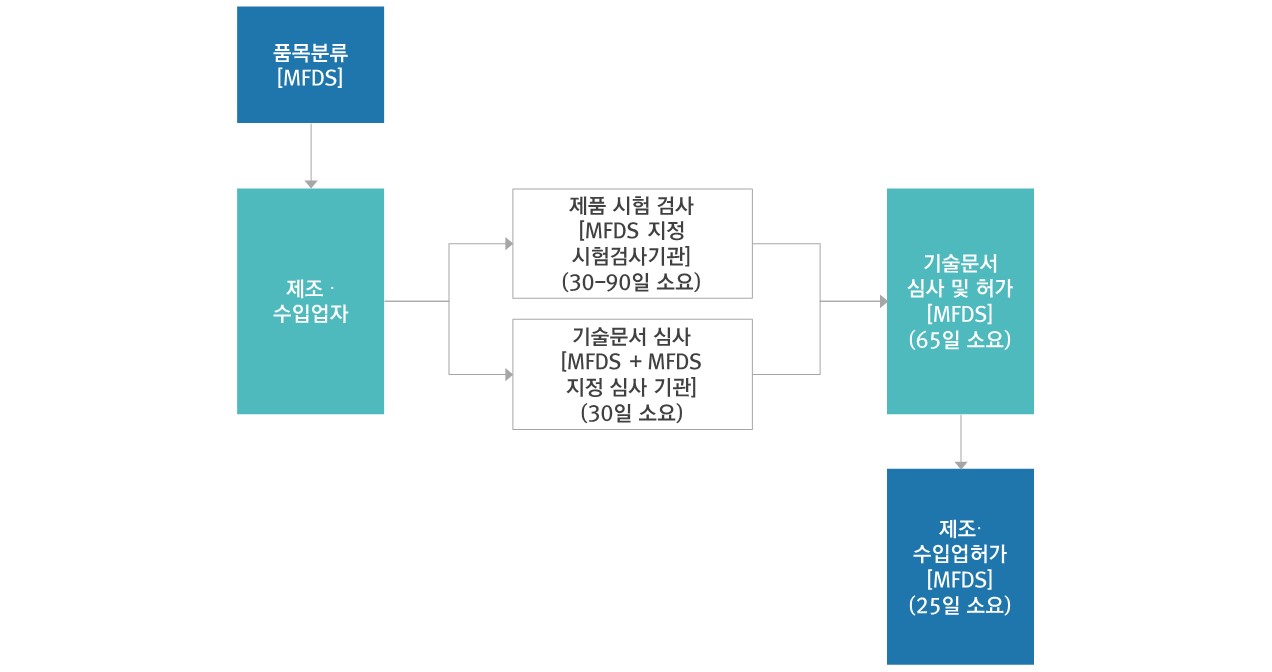
- 기술문서 심사필요 - 2등급 : 25일+5일 / 3, 4등급 : 65일
- 기술문서 등 심사불필요 : 10일
▷ 인허가 절차도
- 2등급제품
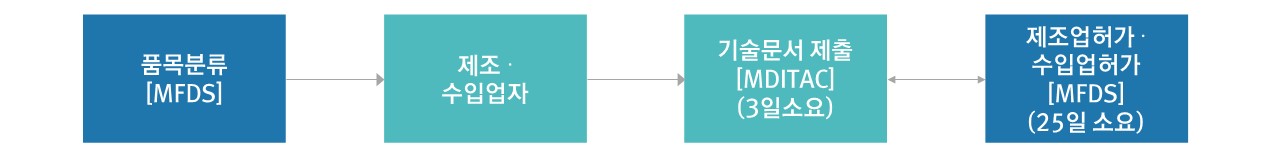
3. 품목 신고
제조/수입
▷ 신고대상 : 제조/수입품목신고를 하고자 하는 자
▷ 처리절차
- 접수기관 : 의료기기정보기술지원센터
- 처리기간 : 식품의약품안전처 전자민원시스템상에 등록이 완료된 시점(3일 소요)
▷ 신고(1등급) 절차도