Understand their needs Translate and expand scope of coverage
 의료기기 컨설팅 > 해외컨설팅
의료기기 컨설팅 > 해외컨설팅
미국에서 의료기기는 "Federal Food, Drug & Cosmetic Act : 연방 식품, 의약품, 화장품법"에 의해 식품, 의약품, 화장품 등과 함께 규제·관리되고 있습니다. 제품에 대한 사전검사 및 승인, 사후검사를 통한 부적합 제품의 제재 그리고 수입품/수출품 검사를 통해 해당 제품의 안전성을 확보합니다. 만약 FDA에서 요구하는 규정을 준수하지 않을 시 미국 내 유통 및 판매가 불가하며 판매 중인 제품이라도 의료기기 규정에 만족되지 않는 제품은 FDA 사후 관리에 의해 시정조치, 리콜, 제품 압류나 폐기 처분, 형사처분 등이 이루어 질 수 있습니다.
- FD&C Act (Federal Food, Drug & Cosmetic Act : 연방 식품, 의약품, 화장품법)
- 21 CFR (The Code of Federal Regulations : 연방법규집)
- 식품, 화장품, 의약품 및 의료기기(부속품 포함), 동물용 약품, 동물사료, 유아용 유동식, 식품첨가물, 저산성통조림, 산화식품 (단, 육류, 가금류 및 육가공품의 경우 농무부 위생검역국(FSIS, Food Safety & Inspection Service)에서 검사 및 규제 시행
- 방사선기기(전자제품) : 초음파 치료장비, Sunlamp, X-rays, TV수신기등
| 1등급 (Class Ⅰ) | - 인체에 건강과 안전에 심각한 위험을 주지 않는 비교적 단순한 기능의 용구
- 일반규제(General Controls)에 따름 - 시판전 신고(Premarket Notification 또는 510(K)): 특정제품에 한하기 때문에 미리 제품의 해당여부 확인 |
|---|---|
| 2등급 (Class Ⅱ) | - Class Ⅰ 보다 인체의 건강과 안전에 직접적인 영향을 끼칠 수 있는 의료기기들로 일반 통제검사 이외의 추가요건을 충족 시켜야 함(한국의 2등급 제품과 유사하게 대부분의 의료기기가 Class Ⅱ에 해당)
- 일반규제(General Controls) 및 특별규제(Special Controls)에 따름 - 시판전 신고(Premarket Notification 또는 510(K)): 예외의 품목도 있으므로 해당 제품의 확인 필요 |
| 3등급 (Class Ⅲ) | - 인체의 건강과 안전에 심각한 영향을 끼칠 수 있는 의료기기 - Class Ⅰ, Ⅱ의 일반통제는 반드시 거쳐야 함은 물론 판매전 승인(PMA) 절차를 통해 인허가(Class Ⅲ 제품은 일단 통지만으로도 미국 시장에 진출할 수 있는 Class Ⅰ, Ⅱ(Ⅱ중 일부) 제품과 달리 FDA의 승인을 받은 후에만 시장진입이 가능) - 일반규제(General Controls) 및 특별규제(Special Controls), 시판전 승인(Premarket Approval, PMA)에 따름 |
의료기기란, 기계, 기구, 도구, 장치, 삽입물, 체외 시약 또는 기타 유사하거나 관련된 물품으로 다음과 같은 모든 부속품 또는 액세서리를 포함한다.
1. USP, NF 또는 USP나 NF 추보에 수재된 것
2. 인간 또는 동물의 질병 또는 기타 상태의 진단, 치료, 경감 또는 예방의 목적으로 사용되는 것
3. 인체 또는 동물의 체내 구조 또는 기능에 영향을 미치는 것으로서 신체와의 화학작용이나 신진대사에 의하여 의도되는 목적을 달성하는 것은 제외
|
등급 |
규제 사항 |
|||
|
규제 수준 |
시판 전 심사절차 |
시판후 관리 |
||
|
Class Ⅰ |
일반관리 |
면제 |
대부분 Class I 제품(단, 미국 내 수입자의 경우 유통 30일 전 제품 및 시설을 FDA에 등록, 해외 제조업자는 선적 전에 제품 및 시설 등록 필요) |
부작용보고 |
|
510(k) |
일부 품목 510(k) 신고 |
부작용보고 |
||
|
Class Ⅱ |
일반관리, 특별관리 |
510(k) |
대부분의 Class Ⅱ 제품 |
부작용보고 시판 후 조사 및 추적관리(FDA가 특별 지정한 의료기기만 해당) |
|
510(k) |
일부 Class Ⅱ 제품(단, 미국 내 수입자의 경우 유통 30일 전 제품 및 시설을 FDA에 등록, 해외 제조업자는 선적 전에 제품 및 시설 등록 필요) |
|||
|
Class Ⅲ |
일반관리, PMA |
PMA |
대부분 Class Ⅲ |
|

안전, 건강, 환경 및 소비자보호와 관련해 EU 이사회 지침의 요구사항을 모두 만족한다는 의미의 통합규격인증마크입니다. 유럽연합(EU) 시장에서 상품을 판매하기 위해서는 의무적으로 제품상에 CE 마킹이 표기되어야 하며 제품 또는 포장, 첨부 문서에 부여 합니다. CE 마크표시 제품은 CE 역내에서의 자유 유통이 보증됩니다.
- EN ISO 13485
- Council Directive 93/42/EEC of 14 June 1993 concerning medical devices
- CE / MDD(93/42/EEC) 일반의료기기, CE / IVD(98/79/EC) 체외진단용 의료기기, CE / AIMDD(93/68/EEC) 능동삽입용 의료기기 등
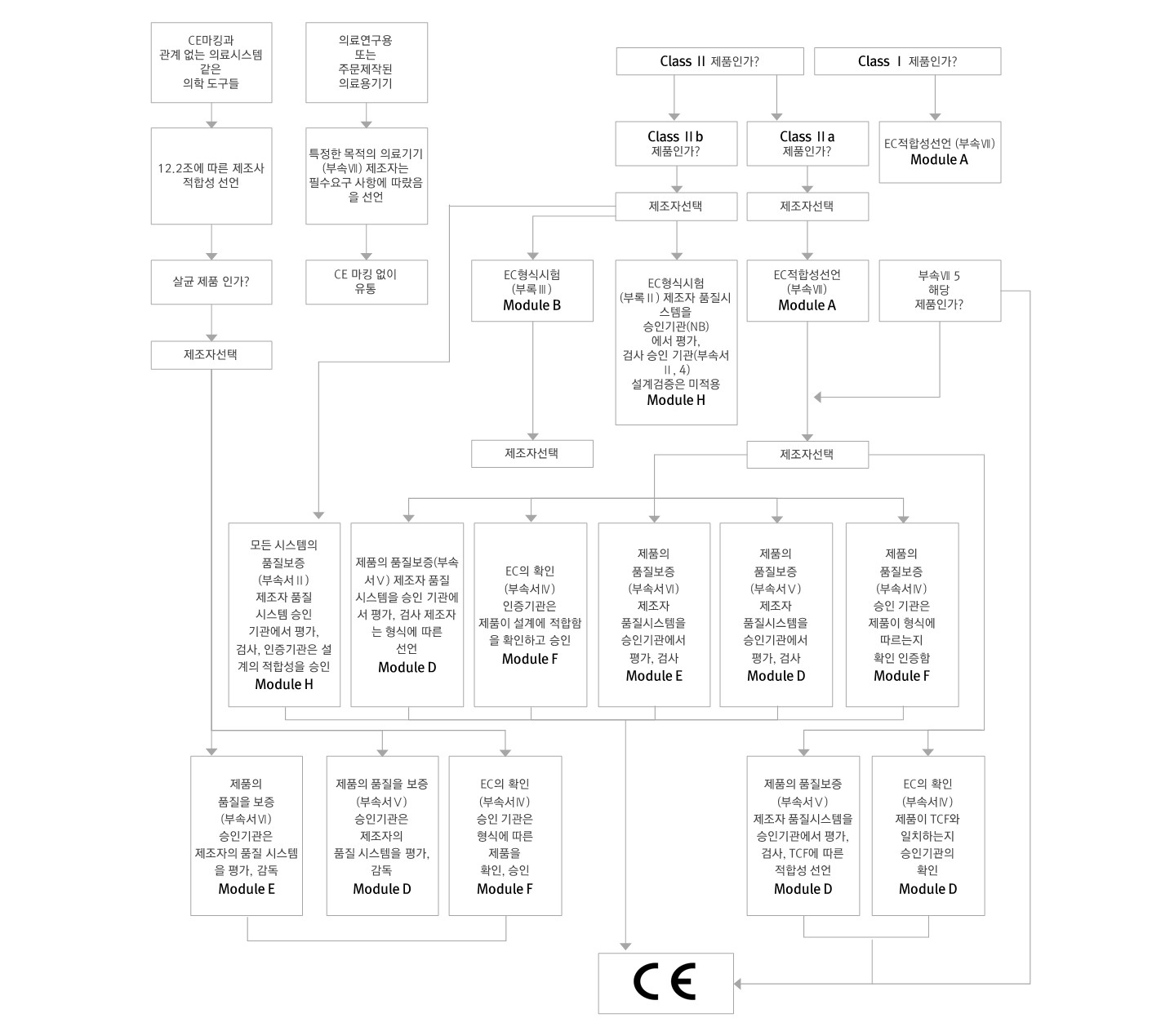
가이던스 Classification of Medical Devices - MEDDEV 2.4/1 에 따라 Ⅰ, Ⅱa, Ⅱb, Ⅲ의 4가지 등급으로 분류하며, 제조자가 분류 규칙에 따라 자율적으로 분류합니다. 만약, 분류에 대한 문제로 분쟁이 생길 경우 최종판단은 인증기관이 속한 국가의 법원에서의 판결에 의하는 것으로 규정되어 있습니다. 같은 품목이라도 사용목적과 효능, 사용되는 시간, 구조, 원자재에 따라 등급은 달라질 수 있습니다.
※ 분류기준(Classification criteria)
기간(Duration) : 임시-60분 이내, 단기-30일 이하, 장기-30일 이상
삽입 의료기기(Invasive device) : 체강 또는 피부를 통하여 인체내에 전체 또는 부분적으로 삽입 되는 기기
작동 의료기기(Active device): 전기적인 에너지나 동력에 의해 사용되는 기기
※ 분류(Classification)
비삽입기기(Non-invasive devices) : Rule 1∼4
삽입기기(Invasive devices) : Rule 5∼8
작동기기(Active device) : Rule 9∼12
특별규칙(Special rules) : Rule 13∼18

TGA는 호주의 의약품, 의료기기, 유전자 기술, 혈액 제품 등을 규제하는 기관입니다. 호주 내에서 의료기기를 판매하기 위해서는 반드시 ARTG(Australian Register of Therapeutic Goods)에 등재해야 하며, 신청인은 의료기기의 호주 내 수입, 공급, 호주로부터의 수출 등에 책임을 가질 뿐 아니라 의료기기의 ARTG 등재 신청에 대한 책임 또한 가지며 신청인은 반드시 호주 내 거주해야 하며 호주 내 사업을 운영하며 대표자가 호주 내 거주자여야 합니다. 또한 호주는 CE 마크를 인정하기 때문에 의료기기의 유럽 CE 마크를 이미 획득하였다면 호주에 제품을 수출하기 위해 별도의 인증을 받을 필요는 없습니다. 하지만 의료기기 또는 IVD에 CE 마크가 있더라도 제품을 TGA에 등록해야 하며 특정 등급의 제품은 의무적인 감사를 받아야 합니다.
호주 치료제 규정 1989 Therapeutic Goods Act 1989
호주 치료제(의료기기) 규정 2002 Therapeutic Goods (Medical devices) regulations 2002
호주 치료제규정(The Act 1989)은 의료기기를 다음과 같이 정의합니다..
다음의 하나 이상의 목적에 대해, 사람에게 사용되기 위해 의도되거나, 공급되는 기구, 장치, 기계, 물질 또는 기타 물품(단독이나 조합하여 사용되는 의료기기와 제품의 소프트웨어 또는 단독으로 사용되는 소프트웨어도 포함)
1. 질병의 진단, 예방, 감시, 치료 또는 경감
2. 상해, 장애를 위한 진단, 감시, 치료, 경감 또는 보정
3. 해부학 또는 생리학적인 절차의 검사, 대체 또는 변형
4. 임신의 조절
5. 약리학적, 면역학적 또는 대사 수단으로 인체에서 주요 의도 작용을 수행하지 않고 그러한 기능에 수단에 의해 도와 질 수 있거나 그러한 기구, 장치, 기계, 물질 또는 물품의 부속품
- (2A)항에 의거하여 지정되는 일체의 기구나 장치, 기기, 재료, 기타 물품
- (2B)항에 의거하여 지정되는 기구나 장치, 기기, 재료, 기타 물품 등급에 포함되는 일체 의 기구나 장치, 기기, 재료, 기타 물품
- (a), (aa), (ab)호가 적용한 해당 기구나 장치, 기기, 재료, 기타 물품의 부속품
호주에서 의료기기는 위험 수준과 기기의 의도된 목적에 따라 5단계로 분류 됩니다.
| 분류 | 위험도 | 내용 |
|---|---|---|
| Class I | 저위험도 | 낮은 수준의 제품평가 메스, 압축붕대, 치과용키트 |
| Class Ⅱa | 중-저위험도 | 낮은 중간 수준의 제품 및 품질시스템 평가 보청기, 마취 제공용 마스크 |
| Class Ⅱb | 중-고위험도 | 중간 중간 수준의 제품 및 품질시스템 평가 콘덤, 혈액백, 주입펌프 |
| Class Ⅲ | 고위험도 | 높은 수준의 제품, 품질시스템 및 설계 평가 심혈관 스텐트, 관절 보철, 심장판막 |
| Active implantable medical device (AIMD) | 고위험도 | 높은 수준의 제품, 품질시스템 및 설계 평가 맥박 조정기, 이식형 제세동기 |
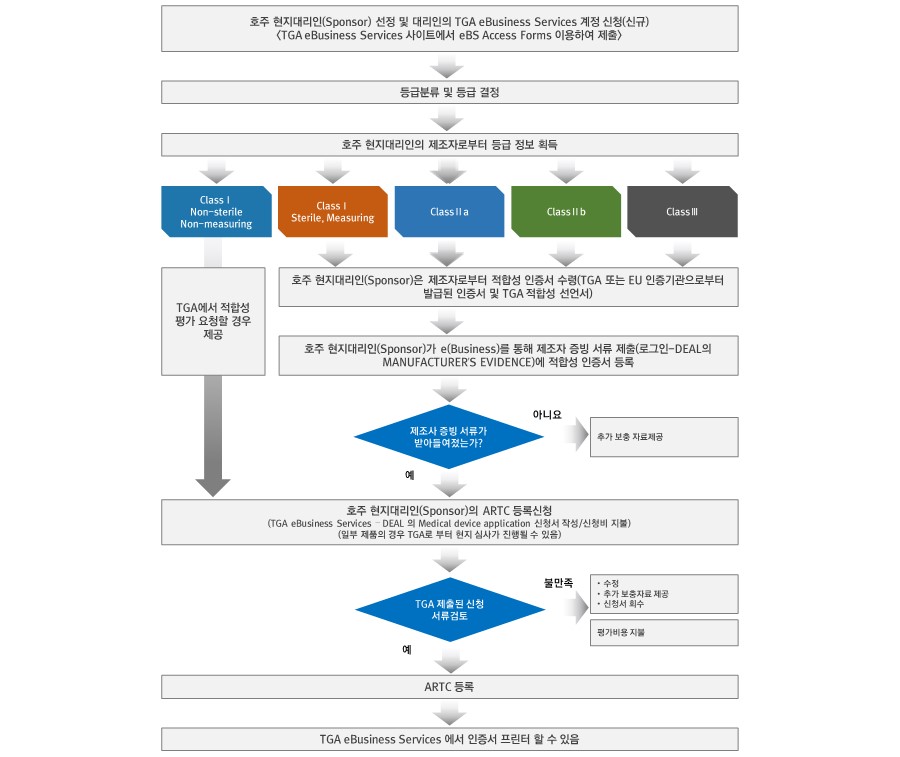
1. 업허가:
- 제조자 증빙(Manufacturer’s evidence)
1) 호주 시장에 판매되기 전에 호주치료제등록부(ARTG, Austalian Register of Therapeutic Goods)에 등록되어야 하는데, 호주치료제등록부는 TGA 웹사이트
2) 해외 제조자는 호주 현지대리인(Sponsor)을 통해야만 ARTG에 등록할 수 있음. 현지대리인(Sponsor)은 호주에 거주하고 있는 개인 또는 회사 법인으로 호주 내에서 합법적으로 사업을 영위하고 있어야 하며 제조자와의 서면계약을 통해 TGA에서 요청하는 자료의 제출, 제품에 대한 부작용 보고, ARTG 등록 시 수수료 납부 등의 의무를 가짐
2. 품목허가
3. 품질관리
ISO 13485
TGA에서는 적합성 평가 시 품질관리시스템이 적용된 것으로 판단하여 ISO 13485 인증서를 따로 요구하지 않음
적합성 평가 절차
part 1 : 전체 품질 보증 절차
part 2 : 유형 검사 (샘플을 이용한 시험을 포함)
part 3 : 검증 절차 (출 시전 테스트를 포함)
part 4 : 생산품질보증 (생산 및 최종 검사를 포함한 품질 경영 시스템
part 5 : 제품 품질 관리 시스템
part 6 : 적합성선언 (의료기기 기술문서를 준비하고 사후 시장 감시 시스템 구축)
part 7 : 특수 목적 사용 의료기기에 대한 적합성평가 절차
part 8 : 임상검증을 위한 평가 절차

Agencia Nacional de Vigilancia Sanitar
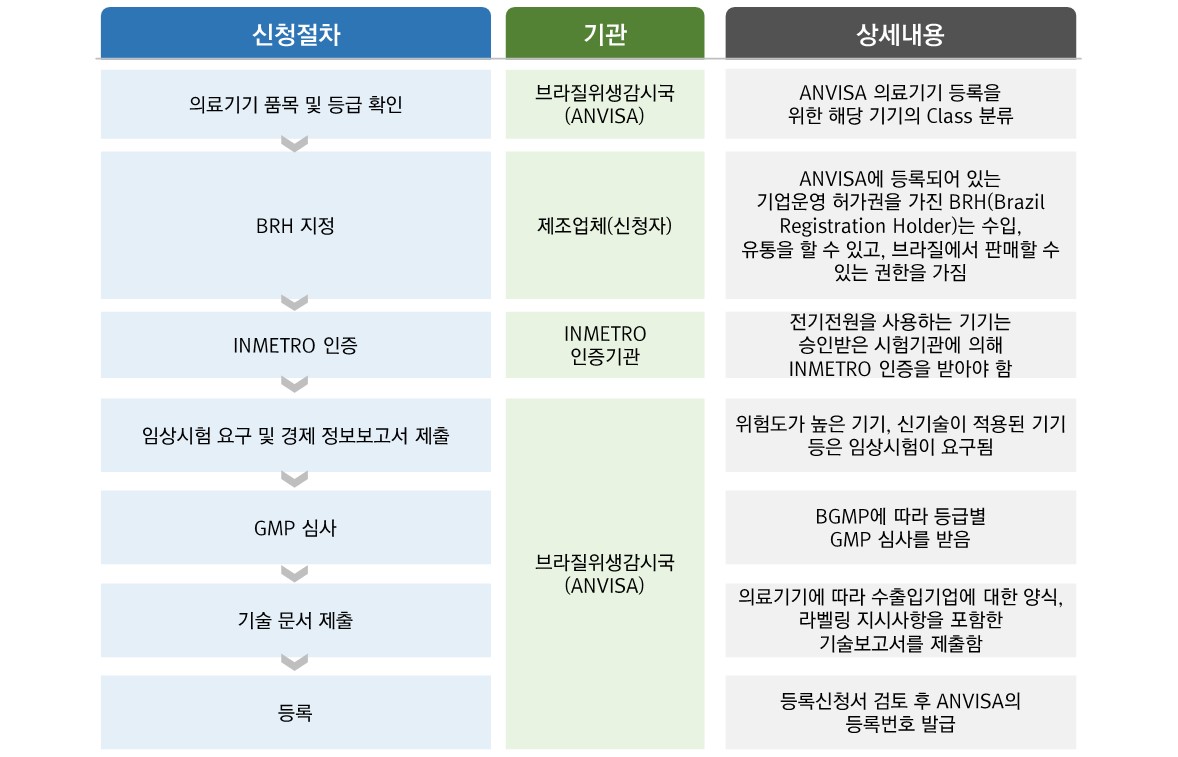
브라질의 의료기기 인증 ANVISA는 한국 식품의약품안전처와 유사한 업무를 하는 기관인 브라질 Ministério da saúde(보건복지부)의 산하 관리감독 행정 기관이며, 브라질 국민의 위생 및 건강과 관련되는 모든 제품 및 업체의 인허가, 관리 감독을 독립적으로 운영하는 대통령 직속기관입니다. 브라질 내에서 유통을 위해서는 ANVISA 인증을 취득해야 하며 한국이나 미국에서 인증 취득이 의무가 아닌 제품에 경우에도 브라질에서는 인증이 요구되는 경우가 있어 ANVISA 인증 요구 제품인지 사전에 확인할 필요가 있습니다. 또 ANVISA 인증은 브라질 현지 업체가 아니면 취득이 불가능하기 때문에, 외국업체의 경우 현지법인 지사 또는 전문 대행업체를 통해야 취득이 가능합니다.
브라질 규격 SINMETRO, ABNT, INMETRO, CONMETRO
의약품, 의료제품(기계장비포함), 식품, 화장품, 세제, 담배, 혈액 및 혈액제품 등이며 이들 품목을 취급하는 현지 제조사, 수입업체, 유통법인 및 병원의 인허가 등이 해당되며 브라질 의료기기는 다음과 같이 정의 됩니다
부품 및 부속품을 비롯하여 다음과 같이 위생 감독 관리 하에서 장비로 간주된다
I – 인간에 대한 진단, 치료, 재활 및 모니터링을 위해 직접적으로 혹은 간접적으로 상용되는지 여부에 상관없이 의료, 치과, 실험실, 물리치료 목적을 지닌 장비
2. 상해, 장애를 위한 진단, 감시, 치료, 경감 또는 보정
II – 미용 및 미학적 목적을 지닌 장비
브라질은 RDC 185에 의해 인체에 대한 위험성에 따라 4개 등급으로 분류하여 관리하고 있습니다.
(RDC 185/2001 부속서 II 위험 수준 기반 의료기기 분류 지침)
| 분류 | 정의 |
|---|---|
| 1군 Class I | 사용자 또는 공공위생에 위험 제공 가능성이 낮은 제품으로 ANVISA 약식 등록 필요 |
| 2군 Class Ⅱ | 사용자 또는 공공위생에 위험제공 가능성이 보통인 제품으로 ANVISA 정식 등록 필요 |
| 3군 Class Ⅲ | 사용자 또는 공공위생에 위험제공 가능성이 매우 높은 제품으로 ANVISA 정식 등록 필요 |
| 3-a군 Class Ⅳ | 자가테스트 (Auto Test)가 필요한 품목으로 ANVISA 정식 등록 필요 |
[ 브라질 의료기기 등록 Flowchart ]
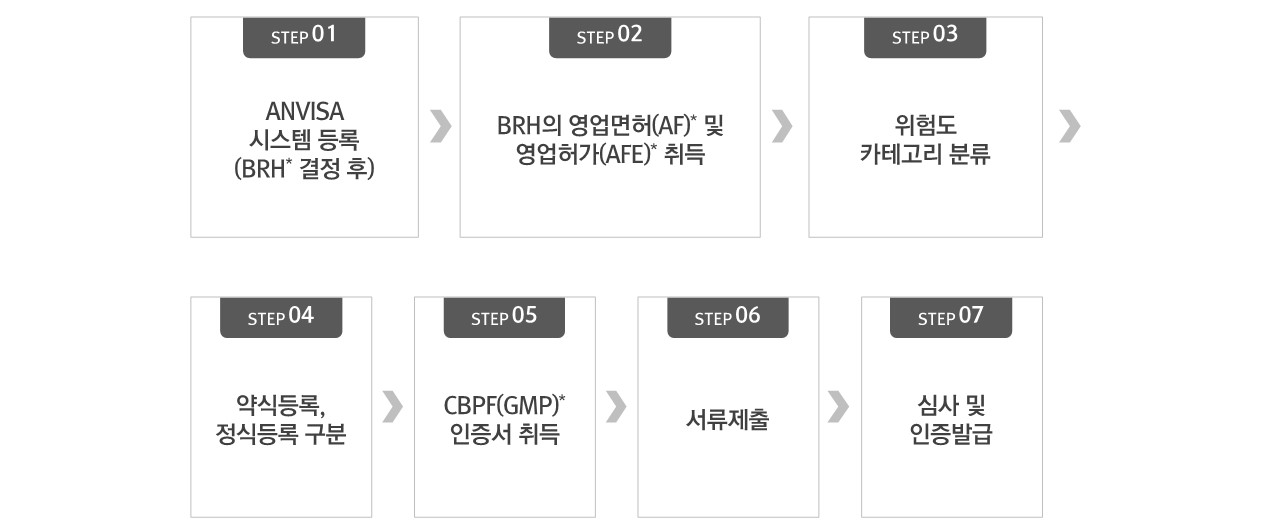
[ ANVISA 인증절차 ]

캐나다의 식품 및 의약품 법에서는 제조업자가 “의료장비”로 정의한 특정 의료제품을 캐나다 시장에 판매하기 전에 반드시 ‘의료장비 License’를 획득하도록 하고 있습니다. 캐나다의 경우 1등급 의료기기와 체외진단용 의료기기 제조업체들이 유통업체를 통하지 않고 캐나다로 직접 의료기기를 수출하고자 한다면 헬스 캐나다 의료기기 시설허가(MDEL)를 취득해야 합니다. 2~4등급의 의료기기에 대해서는 의료기기 허가(MDL)가 요구 됩니다. 이는 미국 FDA 510(k)의 절차와 유사합니다. 또한 캐나다의 의료기기 허가를 신청하는 경우 ISO 1385 품질시스템을 보유하고 있다는 것도 증명해야 합니다.
모든 의료장비는 위험 정도에 따라 Class I~IV로 분류되며 Health Canada에서 발행하는 라이선스 종류에는 Device(기기) License와 Establishment License(medical device establishment license; MDEL)가 있습니다.
식품 의약법 (Food and Drug Act)
Canadian Medical Devices Regulation(CMDR, SOR/98-282)
캐나다의 의료기기 적용은 다음과 같습니다.
의료기기란 아래의 목적으로 제작, 판매, 사용되는 물품, 기구, 기계 또는 장치(부속품 포함)를 말한다.
1. 질병, 질환 또는 비정상적인 신체 상태나 징후를 진단, 치료, 완화, 예방하는 것
2. 신체 기능 또는 신체 구조를 회복, 치료, 변경하는 것
3. 인간의 임신 진단
4. 인간의 임신기간 및 출산 후 관리 피임기구를 포함하지만 의약품은 제외함
표 들어감
| 분류 | 위험도 | 내용 |
|---|---|---|
| Class I | Lowest | 문제가 발생하더라도 인체에 위험이 매우 낮은 경우 X선필름, 휠체어, 흡인기, 의료용품(개구기 등)등 |
| Class Ⅱ | Low | 문제가 발생하더라도 인체에 위험이 상대적으로 낮은 경우 MRI장치, 콘텍트렌즈, 임신테스트기 등 |
| Class Ⅲ | Moderate | 문제가 발생하면 인체에 위험이 상대적으로 높은 경우 정형외과용 임플란트, 혈당모니터링장치, 치과용임플란트, 투석기 등 |
| Class Ⅳ | High | 환자의 생명과 직결되는위험도가 높은 경우 페이스메이커,심혈관용 카테터, 동맥류 클립 등 |
1. 업허가:
- ClassⅠ의 의료기기 제조업체 및 ClassⅡ, Ⅲ, Ⅳ의 의료기기를 수입하는 수입 업체 및 유통 업체는 의료기기 업허가(MDEL)를 취득해야 함. 단 ClassⅠ의 의료기기가 캐나다 내의 MDEL을 보유한 수입업체 및 유통업체에 의해 수입, 유통되는 경우 취득이 필요 없음. 해당 라이선스가 없는 업체는 의료기기 제품을 수입, 유통 할 수 없으므로 현지 바이어가 라이선스를 취득했는지 여부 확인
- 캐나다 보건부에서는 의료기기 업허가 승인서를 공고하고, 매년 재공고함.
- 의료기기 업허가의 경우, 허가증에 유효기간을 규정하고 있지는 않으나 MDR 46(2)에 의거, 매년 12월 31일에 효과가 만료되므로 종기의 규정으로 볼 수 있으며, 따라 서 매년 갱신 하여야 함.
2. 품목허가
제조업체가 직접 신청하는 것이 원칙이나 캐나다 수입자가 제조업체의 권한 위임 하에 대신 신청이 가능함.
1. 의료기기 업허가(MDEL)
2. 해당 의료기기에 대한 등급 분류 확인(CMDR)
3. 등급별 허가 절차
- Class Ⅰ: (1) 의료기기업허가(MDEL) 신청서 제출(캐나다보건부)
- Class Ⅱ, Ⅲ, Ⅳ
(1) 캐나다 보건부에서 지정한 CMDCAS 인증기관을 통해 ISO 13485:2003 인증
(2) 의료기기 인증 신청서 및 ISO 취득인증서 사본 제출(캐나다 보건부)
(3) Class Ⅲ, Ⅳ 는 시판전 검토문서(Premarket Review Document) 검토
4. 캐나다 보건부 승인 완료(온라인으로 MDL 꽁표, 1년마다 MDEL 재공표)
3. 품질관리 (GMP)
캐나다 보건부는 2003년부터 캐나다 의료기기 적합평가 제도 CMDCAS)를 제정하여 캐나다에서 판매 되는 모든 의료기기에 대한 필수 인증 취득을 의무화 하고 있음. 필수 인증으로는 국제 공인기관에서 발급하는 ISO13485와 캐나다 보건부에서 발급하는 의료기기 라이센스를 들 수 있으며, 의료기기 라이센스는 ISO13485 취득 업체만 신청 가능함
ClassⅡ, Ⅲ, Ⅳ등급 의료기기 제조자에게 품질시스템 요구사항의 적합함을 증거로서 캐나다보건부에 의해 인정된 제3자 인증기관에 의해 발행된 품질시스템 인증서 (CAN/CSA ISO 13485:2003)를 요구하고 있음
- 의료장비 규정에 따르면 의료장비의 수입사 또는 유통사가 등록된 품질 시스템을 유지할 필요는 없으며 품질시스템 유지는 제조사의 책임임
- 의료장비 규정에서는 Class II, III, IV 의료장비가 CAN/CSA ISO 13485:2003에 따라 제조되거나 (Class II) 설계 및 제조되어야 한다(Class III & IV)라고 명시 되어있음
- Class I 장비에 대해서는 규제 상의 품질시스템 요건이 없음

CFDA(China Food & Drug Administration)는 중국 국무원 산하 기관으로 전국의 의료기기에 대한 관리 및 감독의 책임을 지고 있으며, 한국 식약처와 유사합니다. CFDA 인증 취득은 중국 의료기기 시장 진출에 있어 강제적이고 필수적인 기본 요구 조건이며, CFDA에서 제정한 의료기기 제품 등록 관리 방법의 규정 및 절차에 따라 판매되고 있는 의료기기에 대해서 지속적인 사후 감독을 시행함으로써 소비자들의 의료기기 사용의 안정성과 유효성을 보장하고 있습니다.
1. 행정허가법(법률)
2. 의료기기 감독관리조례(법규)
중국은 아래의 내용과 같이 의료기기를 정의하고 있습니다.
단독 혹은 다른 기기와 조합되어 직접 또는 간접으로 인체에 적용되는 기기, 설비, 기구, 체외진단 시약 및 혼합물, 이와 유사한 자재 또는 컴퓨터 소프트웨어를 포함하고, 물리적 기능을 주 효능으로 하고 약리학, 면역학 또는 대사 등의 방식으로 효력하지 않으며(역할을 하더라도 이러한 수단은 단지 보조 작용으로만 수반됨), 다음 각 호의 어느 하나에 해당하는 목적으로 사용되는 제품을 말한다.
1. 질병의 진단, 예방, 감시, 치료 또는 경감(완화)
2. 상해 또는 장애 상태의 진단, 치료, 감시, 완화 또는 보충
3. 해부학적 구조 또는 생리학적 과정의 연구, 검사, 대체, 또는 조정
4. 생명의 연장 또는 유지
5. 임신조절
6. 진단과 치료에 정보를 제공하기 위한 인체에서 유래한 표본 검사
중국의 의료기기는 크게 1, 2, 3 등급으로 총 3개의 등급으로 구분하고 있습니다. 의료기기의 등급은 제품이 가지고 있는 위해성을 기반으로 제품의 특성, 사용목적, 사용방법 등을 고려하여 정해집니다.
| 등급 | 위험도 | 내용 |
|---|---|---|
| 1등급 | 낮음 | 일반관리를 통한 안전 및 유효성을 보장할 수 있는 의료기기 |
| 2등급 | 중간 | 엄격한 관리하에 안전성 및 유효성을 보장할 수 있는 의료기기 |
| 3등급 | 높은 | 특별한 조치로 엄격히 관리하여야만 안전성 및 유효성을 보장할 수 있는 의료기기 |
|
분류 |
관리방법 |
신청기관/신청인 |
심사기관 |
유효기간 |
|
|
제조 |
수입 |
||||
|
제조업체 |
해외제조업체* |
||||
|
1등급 |
신고 |
지방 FDA |
CFDA |
없음 |
없음 |
|
2등급 |
허가 |
지방 FDA |
CFDA |
5년 |
|
|
3등급 |
허가 |
CFDA |
|||
[ 품목허가 절차 ]
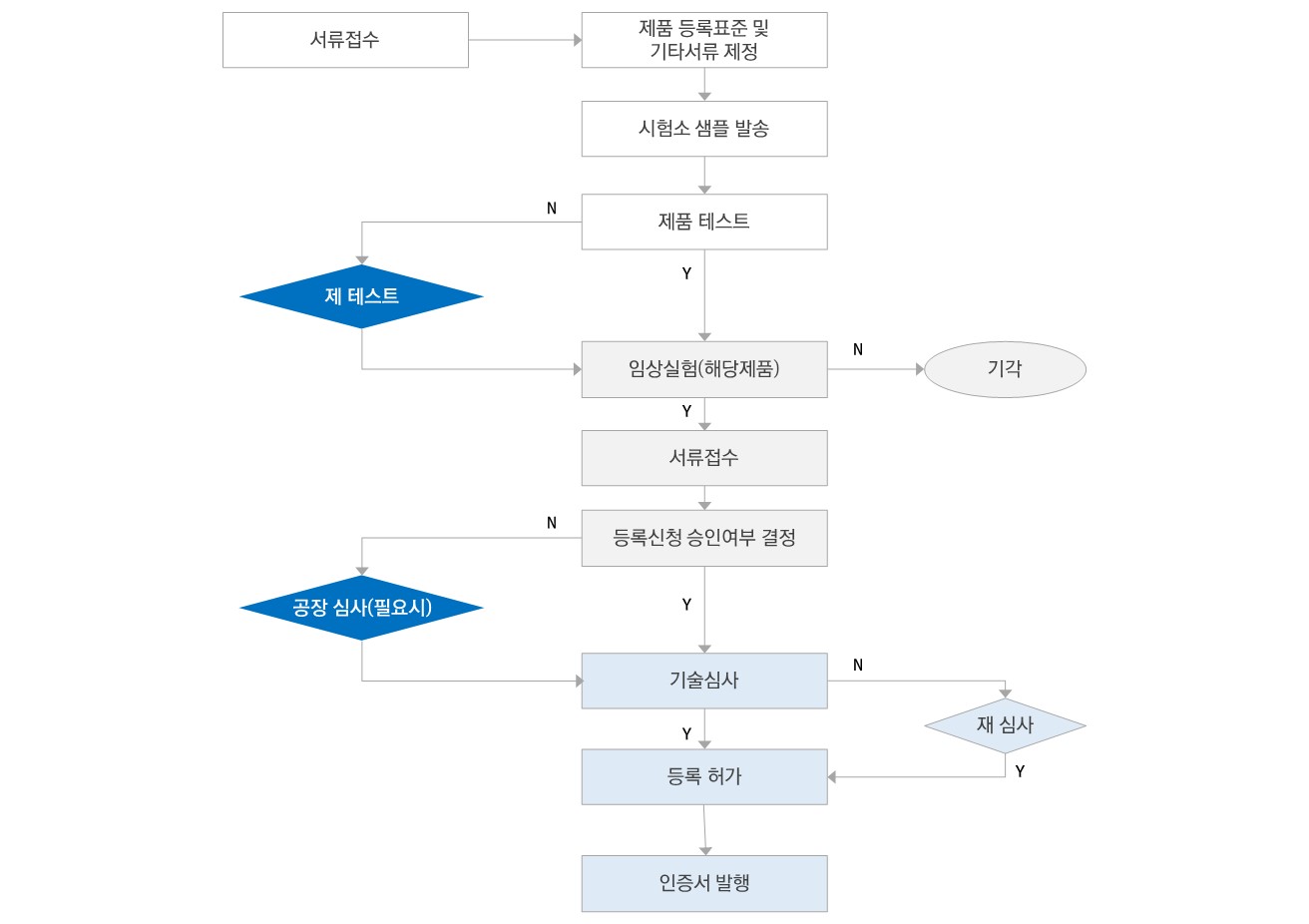
2, 3 등급 의료기기
1) 의료기기 등급 분류
2) 의료기기 검사 및 임상시험(해당 제품만): 지정 시험검사기관에서 제품에 대한 시험 진행
3) 등록 서류 준비
4) 식품약품감독관리국에 접수(5일 이내)
5) 기술심사평가(2등급: 60일, 3등급: 90일)

일본은 식약청(PMDA) 또는 후생노동성(MHLW)이 인정한 제 3자 기관에 의해 승인 또는 인증을 받아야 의료기기의 판매가 가능합니다. 일본 PAL 규정에 따라 일본에서 사업을 하기 위해서는 "허가(Kyoka)"와 "승인(Shonin)"을 받아야 합니다. "허가"는 제조판매업자(MAH), 제조업체, 수리업체 및 유통업체에게 필요한 일종의 사업 면허이며, 제조시설이 일본 이외의 지역에 있는 경우는 제조업체가 제조업체 면허 대신 외국 제조업체 승인을 받아야 합니다. 일본 의료기기는 한국과 마찬가지로 QMS(GMP) 현장심사를 필요로 하며 제품 승인 및 QMS 승인이 모두 통과 되어야 의료기기의 판매가 가능합니다.
일본 약사법 JPAL (Japan’s Pharmaceutical Affairs Law)
일본은 다음과 같이 의료기기를 정의하고 있습니다.
의약품, 의료기기 등 법 제 2조 제 4항
이 법에서 ‘의료기기’라 함은 사람 또는 동물의 질병 진단, 치료 또는 예방할 목적으로 사용되는 제품 또는 사람 또는 동물의 신체 구조 또는 기능에 영향을 미칠 목적으로 사용되는 기계 기구, 의료용품 및 치과재료 및 위생용품으로서 정하는 제품
| 기계기구 | 의료용품 | 치과재료 | 위생용품 | 프로그램 | 프로그램을 기록한매체 |
동물전용 의료기기 |
|---|---|---|---|---|---|---|
| 1-84호 | 1-6호 | 1-9호 | 1-4호 | 1-3호 | 1-3호 | 1-4호 |
| 1. 수술대 및 치료대 84. 전의 각호의 기기의 부족품으로써 후생노동성령으로 정한 것 |
1. 엑스선 필름 6. 시력표 및 색각 검사표 |
1. 치과용 금속 2. 치관재료 9.치과용 연삭 재료 |
1. 월경처리용 2. 탐폰 3. 콘돔 4. 피임용구, 성기구 |
1. 질병진단용프로그램 2. 질병치료용 프로그램 |
1. 질병진단용 프로그램을 기록한 기록매체 | 1. 기계기구의 항 각호(제 84호를 제외) 및 의료용품의 각 호 2. 프로그램 |
| 등급 | 분류 | 내용 |
|---|---|---|
| 1등급 | 일반의료기기 | 문제가 발생할 경우, 인체에 대한 위험이 지극히 낮다고 생각되는 것 |
| 2등급 | 관리의료기기간 | 문제가 발생할 경우, 인체에 대한 위험이 상대적으로 낮다고 생각되는 것 |
| 3등급 | 고도관리의 의료기기 | 문제가 발생할 경우, 인체에 대한 위험이 상대적으로 높다고 생각되는 것 |
| 4등급 | 고도관리의 의료기기 | 환자에 대한 침습성이 높고 문제가 생길 경우 생명의 위험에 직결되는 우려가 있는 것으로 적합성 평가 및 담당 행정기관은 3등급과 같음 |
1. 업허가
제조업, 제조판매업
▷ 업종별 처리기관 등
| 구분 | 제조판매업 | 제조업 |
|---|---|---|
| 관리방법 | 허가(제1종~제3종) | 허가 |
| 신청기관 | 도도부현(47곳) | 제조소(구분별) : 도도부현(47곳), 제조소(세포조직의료기기 등) :지방후생국(7곳) |
2. 품목허가
| 등급 | 분류 | 심사기관 | 유효기간 |
|---|---|---|---|
| ClassⅠ | 일반의료기기 | PMDA에 자가적합 신청 (인증서 발 급 없음) | 없음 |
| ClassⅡ | 지정관리의료기기 | 제 3자 인증기관에서 인증 | 없음 |
| ClassⅡ | 관리의료기기 | PMDA 심사 및 후생노동성 승인 | 없음 |
| ClassⅢ | 고도관리의료기기 | 인증규격이 있는 일부 3등급 의료기기 중 지정된 의료기기에 대해 등록기관을 통해 인증 | 없음 |
| ClassⅣ | 고도관리의료기기 | PMDA 심사 및 MHLW 승인 | 없음 |
3. 품질관리 JGMP
기준 : ISO 13485 + 시설에 대한 추가요구사항 (관련규정 : 성령 제169호 )
- 지정관리의료기기 : 인증기관이 서면 조사 또는 실사 조사 실시
- 고도관리의료기기 : PMDA가 서면조사, 인증기관이 실사조사
※ 고도관리의료기기의 경우 대다수의 품목이 설계관리 실시해야 하는 품목임

Saudi Food and Drug Authority
의료기기나 체외진단용 의료기기(IVD)를 사우디 아라비아에서 판매하기 위해선 사우디 아라비아 의료기기 규제당국인 SFDA에 등록 및 승인이 필수입니다
[ Laws ]
+ 2008-12 Medical Device Interim Regulation
+ 2010-01 Implementing rule on Designation and Oversight of Conformity AssessmentBodies (IR 1)
+ 2010-04 Implementing rule on Establishment Registration (IR 2)
+ 2010-04 Implementing Rule on Medical Devices Listing (IR 3)
+ 2011-02 Implementing rule on Establishment Licensing (IR 4)
+ 2011-02 Implementing Rule on Licensing of Authorized Representatives (IR5)
+ 2011 Implementing Rule on the Validation of Documents to be provided to the SFDA by Manufacturers for Marketing Authorization (IR 6)
+ 2010-01 Implementing Rule on Post-Marketing Surveillance (IR 7)
+ 2010-01 Implementing Rule on Safeguard Procedures (IR 8)
+ 2018-06 Updated Medical Device Interim Regulation
Medical Devices Interim Regulation과 Implementing Rule on the Validation of Documents to be provided to the SFDA by Manufacturers for Marketing Authorization (MDS-IR6)에 의거, SFDA는 MDMA (Medical Devices marketing Authorization (MDMA)라는 시스템을 도입하였습니다. .
MDMA는 전자 시스템으로 현지 의료기기 제조자나 해외 제조자의 대리인이 의료기기 등록에 필요한 모든 문서들을 이 시스템을 통해서 접수를 하게 됩니다.
사우디 아라비아에 판매가 되는 모든 의료기기와 체외진단 의료기기는 그 위험정도에 따라 아래의 강제적용 시기가 있어왔습니다.
| Class | Type | Enforcement Date |
|---|---|---|
| High Risk | In Vitro Diagnostic | Oct 1st 2012 |
| Medical Device | Dec 1st 2012 | |
| Medium Risk | In Vitro Diagnostic | Dec 1st 2012 |
| Medical Device | Dec 31st 2014 | |
| Low Risk | In Vitro Diagnostic | Jun 30th 2015 |
| Medical Device | Dec 31st 2015 |
판매 등록 및 허가를 위해서 해당 의료기기는 먼저 GHTF (Global Harmonization Task Force)에 가입이 된 국가들 (오스트레일이라, 캐나다, 일본, 미국, 유럽연합) 중, 적어도 한 국가의 승인을 획득하여야 합니다. 거기에 사우디 아라비아에서 요구하는 전원관련 요구사항에 만족하여야 합니다. 다른 언어 사용에 대한 SFDA의 사전 승인이 있지 않는한, 모든 제출 서류는 영어로 작성이 되어야 합니다.
등급의 분류는 제출서류의 기반이 되는 GHTF 국가의 것으로 따라갑니다.
제품의 등급 구분이 가능하지 않은 경우, SFDA의 Medical Device Sector에서 발행한 MDC (Medical Device Classification) 시스템에 의거 분류가 가능합니다.
MDC 시스템은 온라인 등급분류 시스템으로, 해당 장비가 의료기기인지 아닌지부터 장비의 기술 내용에 의거 어느 등급에 해당되는지 확인을 도와주는 시스템입니다.
2018년 5월 1일부로 Class I low-risk, non-sterile, non-measuring 기기들에 대한 새로운 등록 절차내용이 발간이 되었습니다. 이에 의거 해당 장비는 두가지의 옵션을 통해 등록이 가능합니다.
- 옵션 1: 판매 허가를 표준 MDMA 절차에 의거 low-Risk, non-sterile and non-measure 의료기기로 획득하고 MDNR 시스템에 등록
- 옵션 2: MDNR 시스템에 List low risk (non-sterile/non-measure) 의료기기로 등록
2008년 12월 27일에 발간된 SFDA의 Medical Devices Interim Regulation (MDIR)에 사우디 아라비아의 판매 허가와 관련된 전체적인 내용이 정의되어있습니다. 이는 의료기기와 모든 부속품을 사우디 아라비아에 판매하는 제조자, 공인 대리인, 수입업자, 판매자에 해당이 됩니다.
8가지의 적용 룰 (Implementing Rules (IR))이 관련된 모든 내용을 정의하고 있으며 이는 사우디 아라비아에서 판매가 되고 사용이 되는 모든 의료기기와 부속품들의 안전과 성능을 보장하기위해서 정의가 되었습니다.
이 8가지의 룰은 아래와 같습니다.
+ IR #1 Designation and oversight of conformity assessment bodies
+ IR #2 Establishment registration
+ IR #3 Medical devices listing
+ IR #4 Establishment licensing
+ IR #5 Licensing of authorized representatives
+ IR #6 Validation of documents to be provided to the SFDA by manufacturers for marketing authorization
+ IR #7 Post-marketing surveillance
+ IR #8 Safeguard procedures

대만 약사법 (Taiwan 's Pharmaceutical Affairs Act) 규정에 따라 대만 시장에 진출하고자 하는 의료기기 제조사는 의료기기의 제조 또는 판매에 대한 라이센스를 취득하고 대만 식품의약국 (TFDA: Taiwan Food and Drug Administration) 및 대만 보건부 (DOH: Department of Health)로부터 의료기기 검토 및 승인을 받아야 합니다. 대만 인허가 시스템은 위험도에 따라서 의료기기를 1~3등급의 3단계로 분류합니다. 2등급 3등급 의료기기는 대만 등록 이전에 본국에서 승인을 받은 것이어야 합니다. 이 시스템은 미국 FDA 의료기기 등급 제도에 기반을 두고 있습니다.
대부분의 경우 제조사는 상세한 회사 설명, 생산 공정에 대한 설명 등을 제출해야 하며 대만의 GMP (Good Manufacturing Practice) 요구사항을 충족하는 품질 시스템 문서 (QSD: quality system documentation)를 제출해야 합니다. ISO 13485 인증은 경우에 따라 대만의 QSD/GMP 요구사항을 준수한다는 증거로 받아 들여질 수 있으며, 의료기기 검토 및 인증 절차를 간소화 할 수 있으며 대만과 유럽 연합 (EU)은 기술 협력 프로그램을 시작함에 따라, 사전에 EU승인을 받은 의료기기의 경우 대만 시장 진출이 용이해 질 수 있습니다.
약사법, 약사법 시행 세부 준수사항, 의료기기 점검 등 기심사 준칙, 의료기기 관리방법, 의료기기 유사제품 판정 흐름 및 신청 설명
대만의 의료기기 관련 주관기관은 ‘행정원 위생복리부 식품약물관리처(TFDA; Food and Drug Administration)’이며 약물법 제13조를 기본 원칙으로 의료기기를 정의합니다
의료기기의 정의는 진료, 치료, 병세의 경감 또는 예방을 위해 신체구조와 기능에 영향을 미치는 기기, 기계, 도구 및 그 부속 부품 등을 칭함.
의료기기는 기능, 용도, 사용방법, 원리 등에 의하여 심장혈관 기기, 일반외과 및 성형외과 기기, 치과기기, 신경과 기기, 물리요법 기기, 산부인과 기기, 임상화학 및 임상독성 기기, 정형외과 기기, 종합병원 및 담당자 사용기기, 안과기기, 면역 및 미생물 기기, 이비인후과 기기, 위장 비뇨기과 기기, 혈액 및 병리 기기, 방사선 기기, 마취 기기 등 크게 17가지로 분류됩니다.
의료기기(비IVD) 등급 분류
| Class I (위험도 낮음) |
생명을 유지하거나 연장하지 않으며 인체 훼손 방지에 있어 상당히 중요한 용도로 사용하지 않고 질병과 부상에 대한 위험 가능성을 가지지 않은 기기
예시) 면봉, 기저귀, 일회용밴드, 기계식 휠체어, 일반 의료용 마스크(외과수술용 제외), 기계식 보행보조기 등 |
| Class II (위험도 중간) |
생명 유지나 연장에 사용할 것으로 인정되는 기기
예시) 렌즈, 혈당기, 혈압계, 체온계, 생리대, 콘돔, 저주파치료기 등 |
| Class III (위험도 높음) |
생명을 유지·연장하는 기기 혹은 인체 훼손 방지에 상당히 중요한 기기이거나 질병 혹은 부상 위험성을 가질 수 있는 기기
예시) 실리카겔 가슴삽입물, 관상동맥 혈관 스텐드, 인공 심장 박동기 등 |
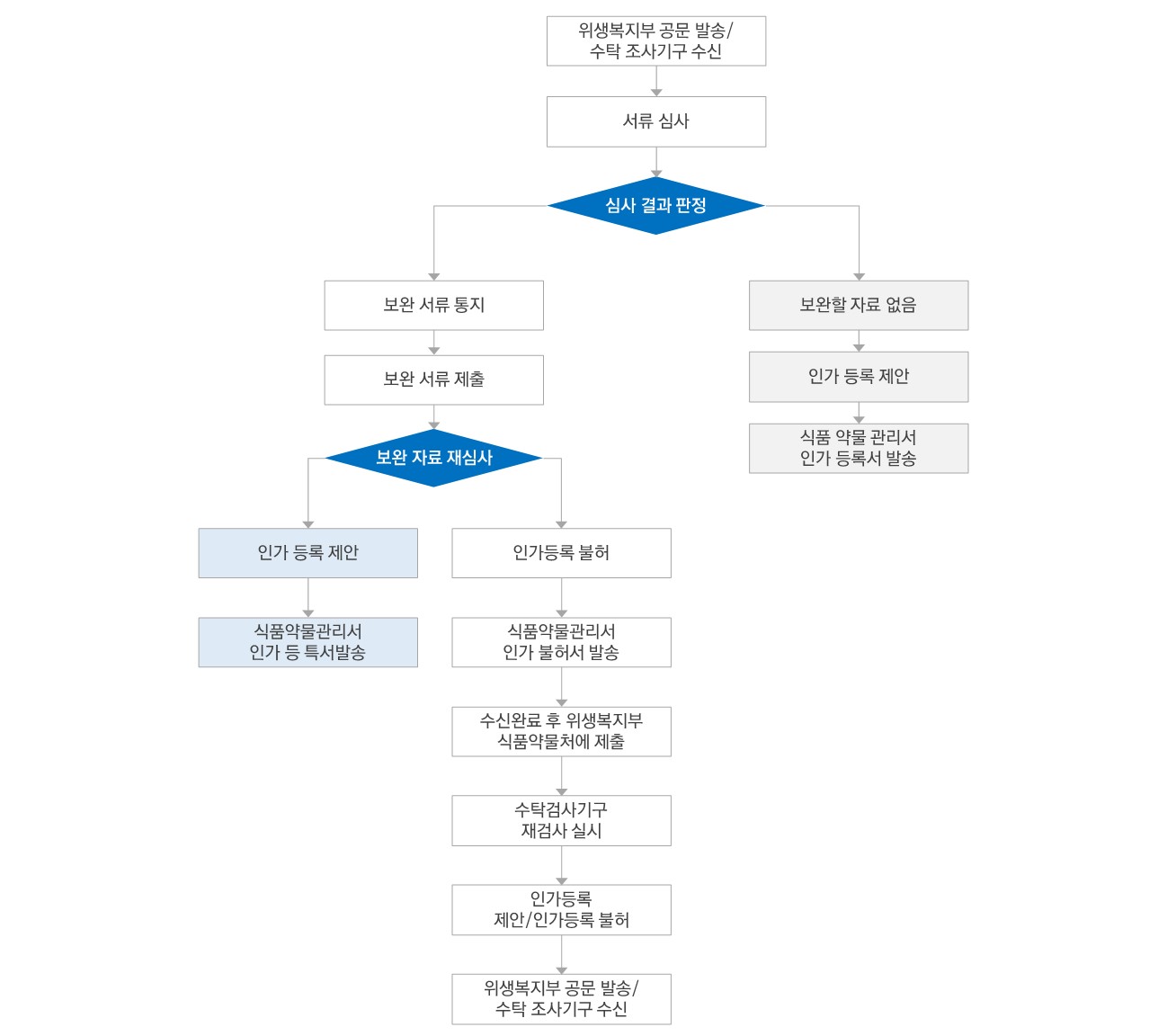

러시아에서 의료기기 제조, 수입, 판매 승인을 얻기 위해서는 건강관리 및 사회개발 관리 연방보건부(The Federal Service for Supervision of Welfare – Roszdravnadzor)의 승인이 필요합니다. 러시아 의료기기 승인은 안전성, 효율성, 품질에 관한 시험 결과에 따라 달라집니다. 시험은 러시아 내의 Roszdravnadzor 신용 인증 시설에서 이루어져야 하며, 다른 해외 시설에서 유사한 시험을 했더라도 인정되지 않습니다
- 법: 「Federal Law of N 323 FZ」: "On the fundamentals of health protection in the Russian Federation" 제 38조(2011.11.21 시행, 2012.06.25 개정)
- 법령: 「Decree N1416 "Rules of state registration of medical devices" (2012.12.27.)」
러시아의 의료기기는 다음과 같이 적용 됩니다.
의료기기는
- 인간의 건강을 관찰
- 의학 연구 시행
- 인체의 해부구조 또는 물리적인 기능의 변화 또는 대체
- 피임 또는 임신중절 수술
- 약학, 면역학, 유전학 또는 물질대사적으로 인체에 영향을 끼치지 않는 병의 예방, 진단, 치료, 재활 목적으로 사용되는 소프트웨어를 포함하는 어떠한 기계, 장치, 기구 또는 물질이다.
| 분류 | 위험수준 | 위험분류 |
|---|---|---|
| 1 | Low Risk | 저위험군 |
| 2a | Moderate Risk | 중간위험군 |
| 2b | Moderate/high Risk | 상당위험군 |
| 3 | High Risk | 고위험군 |
1. 업허가
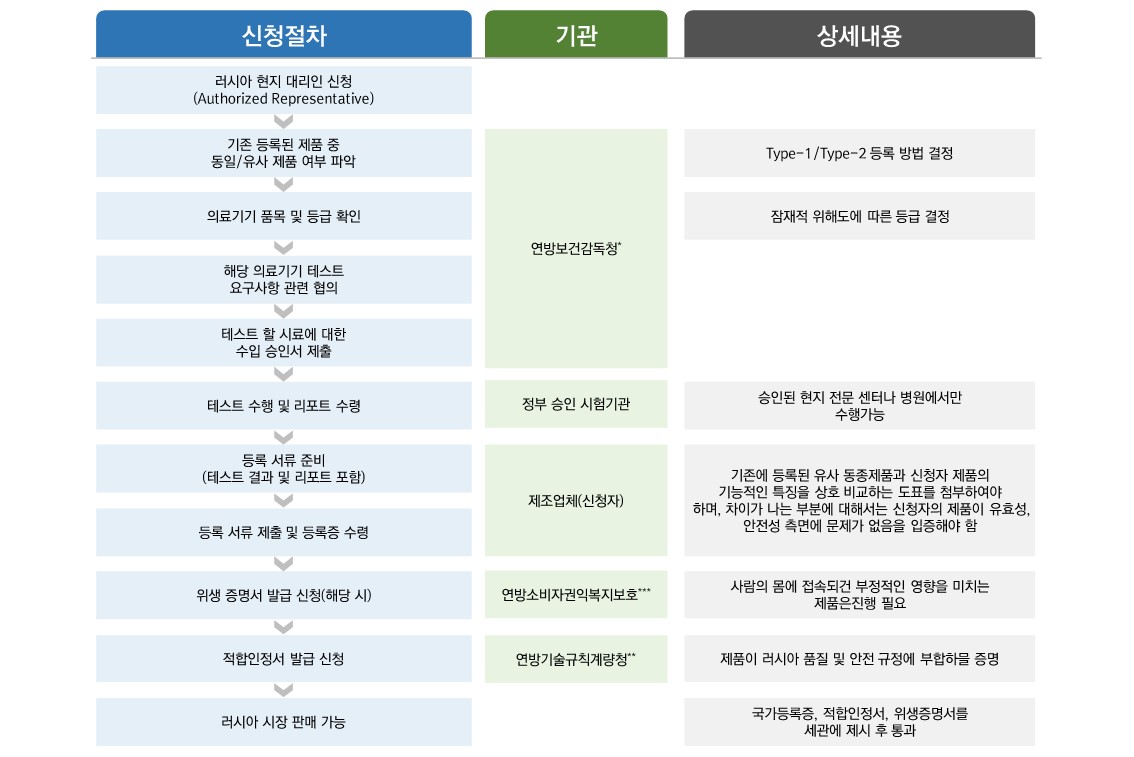
의료기기 제조업자는 연방 보건감독청에 규정된 절차에 따라 제품을 등록하여 등록증명서를 발급받아야 하고, 등록한 제품은 추가로 연방 기술규칙계량청(Gosstandart)의 지정 인증센터(Certification Body)에서 적합성 선언(DOC, Declaration of Conformity)을 통해 GOST-R 인증을 받아야 한다.
품목허가
□ 품목허가심사 절차
1. 이미 등록되어 있는 동일·유사제품 여부 파악(연방 보건 감독청)
2. 의료기기 품목 및 등급 확인(연방 보건 감독청)
3. 해당 의료기기의 테스트 요구사항에 대해 협 (연방 보건 감독청)
4. 테스트 할 샘플에 대한 수입 승인서 제출(연방 보건 감독청)
5. 정부승인 실험실에서(러시아 국내) 테스트 수행
6. 테스트 결과 및 리포트 수령
7. 등록서류 준비 (테스트 결과 및 리포트 포함)
8. 등록서류 제출 및 등록증 수령
9. 연방 보건 감독청에 위생증명서 발급 신청(해당 될 경우)
10. 연방 기술규칙계량청에서 GOST-R (적합인정서) 발급 신청
11. 연방 보건 감독청에 등록 및 웹사이트를 통한 공개
12. 해당 기기는 다른 의례적인 선적서류에 더하여 국가 등록증, 위생증명서를 세관에 제시함으로서 수입 통관되어 러시아 시장에 판매됨
□ 품목허가 유효기간
- 2013년 이후 인증된 기기에 대해서는 유효기간이 없음
http://www.cerins.net/medical-ru/
3. 품질관리
GMP 의무화
기준 : ISO 13485
- EU GMP 가이드라인 승인
- GOST R 52249-2004(러시아 국가 기준) 과 같음.
- Manufacturing and quality control of medicinal products».
- EU GMP 부속18 과 동일
※도입(1990) → 전면의무화(2004)
[ 러시아 의료기기 등록 절차 ]